Onko-Therapie
Forschungsprojekte
CAR-T-Zellen der nächsten Generation für pädiatrisches Rhabomyosarkom
Gruppe Bernasconi, Rössler UnserZiel ist es, bestehendeTherapien für pädiatrische, solide Tumore zu verbessern und wirksamere sowie weniger toxische Therapien zu entwickeln, mit besonderem Fokus auf das Rhabdomyosarkom. Pädiatrische Sarkome machen etwa 15% der pädiatrischen Krebserkrankungen aus. Die Rückfallrate ist in der Regel hoch und die Prognose sehr schlecht.
CAR-T-Zellen sind veränderte T-Zellen, die chimäre Antigenrezeptoren (CARs) exprimieren.Die CAR-T-Zell-Therapie ist einer der vielversprechendsten Ansätze gegen rezidivierende oder anderweitig nicht behandelbare Krebserkrankungen.
Seit 2018 konzentriert sich unser Labor auf diese personalisierte Immuntherapie, um die normale Fähigkeit desImmunsystems des Patienten, den Tumor zu erkennenund anzugreifen, zu verbessern. Wir haben das Rhabdomyosarkom-Surfaceome mittels Proteomics untersucht,und verschiedene Ziele für CAR-T-Zellen identifiziert. Wir führen nun in-vitro- und in-vivo-Experimente durch, um die Aktivität von CAR-T-Zellen gegen Rhabdomyosarkome zu verbessern.
Elektrospray-vermittelte lokalisierte Tumorbehandlung
Gruppe Geiser Ein neuartiges Gerät, das auf dem Prinzip des Elektrosprays basiert, wurde für die lokalisierte Chemotherapie erfunden, bei der das Medikament direkt und begrenzt nur an der Tumorstelle abgegeben wird. Dies könnte eine vielversprechende Option für ein präoperatives Downstaging oder eine palliative Therapie sein. Hierbei handelt es sich um ein Gemeinschaftsprojekt der Universitätsklinik für Pneumologie, Inselspital, der Universität Bern und der FHNW Muttenz. Die lokalisierte und gezielte Anwendung der intratumoralen Verabreichung von Chemotherapeutika führte zu einer signifikanten Reduzierung des Tumors, wie eine Proof-of-Concept-Studie im präklinischen Umfeld ergab.
In Kollaboration mit PD Dr. med. Amiq Gazdhar und PD Dr. David Hradetzky (FHNW)
Eine personalisierte Multi-omics-Entdeckungs- und Validierungsplattform für rezidivierende Plattenepithelkarzinome im Kopf- und Halsbereich
Gruppe Giger Head and Neck Anticancer Center
POLARES Research Group
Die diagnostischen und therapeutischen Entwicklungen der letzten Jahre haben die Prognose für Patienten mit Kopf-Hals-Plattenepithelkarzinomen (KH-PE-Karzinom) verbessert. Trotz dieser Entwicklungen erleidet ein erheblicher Anteil der Patienten, nach einem ersten Ansprechen auf die Standardbehandlung, einen Rückfall. Die Möglichkeiten einer Zweit-Behandlung sind beschränkt, und es fehlt an personalisierten Behandlungsansätzen, die die genomische/epigenetische Landschaft des Tumors berücksichtigen. Ziel dieser Studie ist es, ein Exzellenzzentrum für KH-PE-Karzinome einzurichten, das die Lücke zwischen genomischer Analyse und Umsetzung der Ergebnisse in klinische Studien schließt. Durch die Etablierung einer Multi-omics-Entdeckungs- und Validierungsplattform, unter dem Dach des University Cancer Center Inselspital (UCI), will dieses Konsortium (HNO, Kopf- und Halschirurgie; Medizinische Onkologie; Radioonkologie) herausfinden, wie Veränderungen auf genomischer und epigenetischer Ebene die Karzinomentstehung, das Ansprechen auf die Behandlung und die Resistenz bei KH-PE-Karzinomen regulieren und dadurch neue Mechanismen zur Bekämpfung von Wiederauftreten identifizieren.
Im Namen des Konsortiums:
Prof. Dr. Roland Giger (Lead), Otorhinolaryngology, Head and Neck Surgery; PD Dr. Olgun Elicin, Radio-Oncology; Dr. Simon Häfliger, Medical Oncology; PD Dr. Michaela Medová, Radio-Oncology, DBMR; Prof. Dr. Carsten Riether, Medical Oncology, DBMR; Dr. Daniel H. Schanne, Radio-Oncology
Metastasis-on-Chip-Modell
Gruppe Guenat Das Metastasis-on-Chip-Projekt zielt darauf ab, den metastatischen Prozess zu replizieren, wobei der Schwerpunkt auf der Extravasation und der Koloniebildung liegt. Unsere ersten Studien bewerten das metastatische Potenzial von Krebszellen basierend auf ihren Phänotypen, wobei wir die A549-Zelllinie für nicht-kleinzelliges Lungenkarzinom (NSCLC) verwenden, die unterschiedliche phänotypische Variationen aufweist. Wir haben festgestellt, dass Paraclone, die durch einen mesenchymalen Phänotyp gekennzeichnet sind, erfolgreich extravasieren, während Holoclone mit einem epithelialen Phänotyp dies nicht tun. Darüber hinaus zeigten Paraclone ein signifikant höheres Migrationsverhalten im Vergleich zu Holoclone. Diese Erkenntnisse liefern wertvolle Einblicke in die Mechanismen der Metastase und legen den Grundstein für weitere Untersuchungen gezielter Therapien.
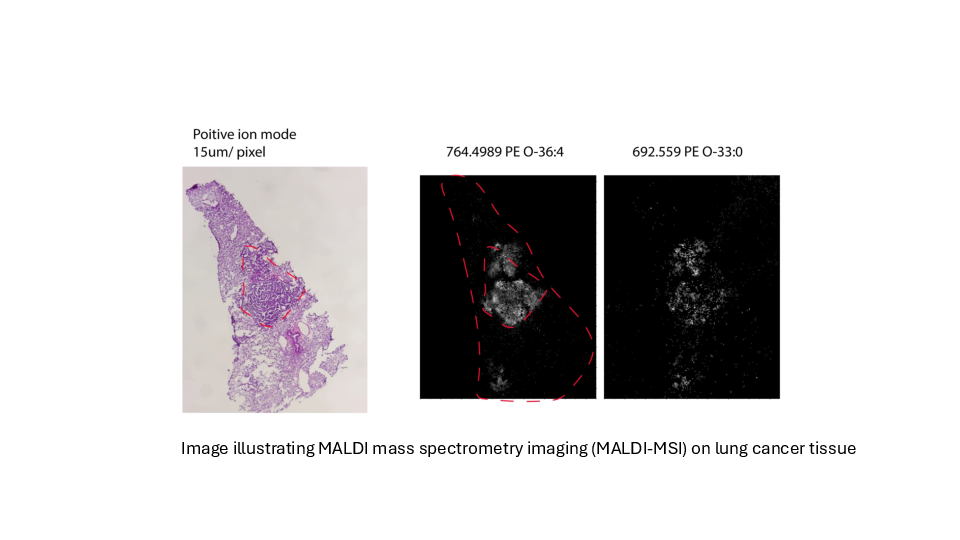
Bestimmung der Tumorlipidheterogenität bei Lungenkrebs
Gruppe Konstantinidou Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Tumorassoziierte Mutationen von KRAS treten bei etwa 30% des nicht-kleinzelligen Lungenkrebses auf, der häufigsten Form von Lungenkrebs. KRAS-Mutationen sind sowohl beim Menschen als auch in Mausmodellen mit aggressiven, metastasierenden und therapieresistenten Krebsarten assoziiert. Mutiertes KRAS treibt ein komplexes Netzwerk von Lipidstoffwechselumlagerungen an, um die Anpassung von Krebszellen an Hypoxie zu unterstützen und ihr Überleben zu sichern.
Wir planen, die Veränderungen des Lipidstoffwechsels zu bestimmen, die in hypoxischen Tumoren auftreten, und ihre funktionelle Bedeutung zu verstehen, wobei wir die Lipidheterogenität von Tumorzelle zu Zelle berücksichtigen und gleichzeitig die räumliche Verteilung von Krebszellpopulationen innerhalb von Tumoren erhalten.
Zielgerichtete Untersuchungen des Zellstoffwechsels zur Verbesserung der Krebstherapie
Gruppe Marti In diesem Projekt wird untersucht, wie der Nukleotid-/Laktat-Stoffwechsel und die DNA-Schadens-Reparatur-Maschinerie mit der Fähigkeit zur Tumorbildung, dem Ansprechen auf Chemotherapie und zur Metastasierung von Lungen- und Mesotheliom-Krebsstammzellen zusammenhängen. Darüber hinaus nutzen wir therapieinduzierte, zelluläre Anpassungen als neue Angriffspunkte für die Krebstherapie.
Onkogene Signalwege von Rezeptortyrosinkinasen im Zusammenspiel mit DNA-Schadensreaktion
Gruppe Medova Tyrosinkinase-Rezeptoren aktivieren eine Vielzahl unterschiedlicher zellulärer Signalwege. Physiologisch ist eine intakte Signalübertragung über den MET-Rezeptor für die Embryonalentwicklung und die Gewebehomöostase unverzichtbar. Gleichzeitig fördert eine MET-Dysregulation Merkmale, die eindeutig mit Tumorwachstum und -progression verbunden sind, wie z. B. unkontrollierte Proliferation, Angiogenese, lokale Invasion und systemische Verbreitung. Immer mehr Daten deuten darauf hin, dass die MET-Signalübertragung Tumorzellen auch vor DNA-Schäden schützen kann, was ihre abnormale Aktivität mit der Resistenz gegen DNA-schädigende Wirkstoffe in Verbindung bringt, die routinemäßig bei der Krebsbehandlung eingesetzt werden. Wir haben eine bisher unbekannte Phosphorylierungsstelle auf MET identifiziert, die von DNA-Schadens-Masterkinasen erkannt werden kann und nicht nur an zellulären Reaktionen auf DNA-Schäden, sondern auch an Metastasierungsprozessen, der Migration von Krebszellen und dem verankerungsunabhängigen Wachstum beteiligt ist. Ziel dieses Projekts ist es, die Natur, Funktion und Regulation dieser Phosphorylierungsstelle bei der onkogenen Signalübertragung des Rezeptors zu untersuchen.
Myeloische Malignome
Gruppe Meyer Myeloproliferative Neoplasien sind chronische Leukämien. Sie sind durch eine konstitutive Aktivierung des JAK2 Tyrosinkinase-Signaling gekennzeichnet. JAK2 Inhibitoren stellen einen Standard in der Behandlung dar, haben aber nur einen begrenzte krankheitsmodizierenden Effekt. Die allogene hämatopoietische Stammzelltransplantation ist bisher der einzige Therapieansatz mit kurativem Potential.
Mein Forschungsteam untersucht das onkogene Signaling, das den MPN zugrunde liegt. Wir konnten zeigen, dass die Aktivierung des MAPK Signaling, eines Pathways der bei verschiedenen Krebsarten eine wichtige Rolle spielt, bei MPN die Wirksamkeit der JAK2 Inhibitor-Behandlung vermindert und gezielt angegangen werden muss (Stivala, JCI 2019; Brkic Leukemia 2021). Das hat Eingang in eine klinische Studie gefunden (Adore, NCT04097821). Weiter untersucht mein Forschungsteam Resistenz-mechanismen, die zu Verlust des Therapie-ansprechens auf die JAK2 Inhibitoren führen. Insbesondere sind wir involviert in die Entwicklung neuer JAK2 Inhibitoren mit verbesserter Wirksamkeit bei MPN, die sich in Entwicklung zu klinischen Studien befinden (Meyer, Cancer Cell 2015; Codilupi, CCR 2024).
Die Interaktion von Immunzellen mit Leukämie- und Krebs-Stammzellen
Gruppe Ochsenbein Unsere Forschungseinheit untersucht die Wechselwirkung zwischen Immunzellen und Krebsstammzellen mit Schwerpunkt auf Leukämiestammzellen. Krebsstammzellen sind gegen die meisten der derzeit verfügbaren Medikamente resistent und für Rückfälle nach einer erfolgreichen Chemotherapie verantwortlich. Wir setzen modernste Techniken ein, um die molekularen Interaktionen zwischen Immunzellen und Krebsstammzellen in Mausmodellen und in klinischen Proben von Krebspatienten zu analysieren. Ziel ist die Entwicklung verbesserter Immuntherapien, die speziell auf Krebsstammzellen abzielen, insbesondere für hämatoonkologische Erkrankungen wie Leukämie und multiples Myelom. Diese neuartigen Medikamente werden in präklinischen Modellen und in klinischen Phasen 1 und 2 Studien getestet.
Design, Synthese, Analyse und Optimierung neuartiger niedermolekularer Inhibitoren gegen Prostatakrebs
Gruppe Pandey Androgene sind mit der Pathologie von Prostatakrebs verbunden. Cytochrom P450 CYP17A1 und Aldo-Keto-Reduktase AKR1C3, die am Steroidstoffwechsel beteiligt sind, sind Angriffspunkte für Arzneimittel. Das aktuelle Medikament gegen Prostatakrebs, Abirateron, das auf CYP17A1 abzielt, ist nicht sehr wirksam und hat Nebenwirkungen. Wir fanden heraus, dass Abirateron die Produktion von CYP21A2 und Cortisol hemmt; und ein Metabolit von Abirateron ist ein starkes Androgen, das letztendlich die Behandlung zunichte macht. Mit Computer- und medizinischen Chemiegruppen aus Dänemark, Polen, Italien und Spanien produzieren wir neuartige Inhibitoren von CYP17A1 und AKR1C3. Wir entwerfen und verbessern die Verbindungen und testen sie im Labor. Nach dem virtuellen Screening wenden wir maschinelles Lernen und automatisierte Arbeitsabläufe an, um Pharmakophore für strukturelle Modifikationen und die Synthese neuartiger Chemikalien zu identifizieren. Zur Steigerung der Wirksamkeit wird eine auf Nanopartikeln basierende Verabreichung eingesetzt. Anhand mehrerer Zell- und rekombinanter Proteinmodelle werden neuartige Inhibitoren getestet, die nun auf nanomolarer Ebene wirken.
Leukämiestammzellen und die umgebenden Strukturen im Knochenmark
Gruppe Riether Das Knochenmark ist eine einzigartige zelluläre Architektur, die das Selbsterneuerungs- und Differenzierungspotenzial von hämatopoetischen Stamm- und Vorläuferzellen durch Zell-Zell-Interaktionen oder die Freisetzung löslicher Mediatoren entscheidend reguliert. Diese evolutionär konservierten Prozesse, die sich entwickelt haben, um normale hämatopoetische Stammzellen vor der Eliminierung zu schützen und bedarfsangepasste Reaktionen bei Entzündungen zu regulieren, werden bei Krebs und Leukämie häufig unterwandert. Ziel unserer Forschung ist es, die molekularen und zellulären Mechanismen zu verstehen, mit denen verschiedene Komponenten des Knochenmarks, wie Immunzellen und Stromazellen, krankheitsauslösende und -erhaltende Leukämiestammzellen (LSCs) beeinflussen und sie vor der immunvermittelten Eliminierung zu schützen. Wir nutzen modernste Technologien, etablierte Mausmodelle für chronische und akute myeloische Leukämie sowie Xenotransplantationsmodelle, um unser Verständnis von LSCs zu vertiefen und unsere Erkenntnisse auf menschliche Erkrankungen zu übertragen.
Die Rolle des Minor-Spleissosoms bei Krebs
Gruppe Rubin Gene bestehen aus kodierenden Einheiten (Exons), die durch nicht kodierende Regionen, den Introns, voneinander getrennt sind. Bei der Herstellung von Proteinen werden Exons zusammengespleisst und Introns aus dem mRNA-Molekül entfernt. Für diesen Spleissvorgang hat die Evolution einen zellulären Apparat, das so genannte Speissosom, hervorgebracht. Alternatives Spleissen ermöglicht die Erzeugung verschiedener Proteinisoformen aus einem einzigen Gen. Unter normalen physiologischen Bedingungen ist der Spleissprozess streng reguliert. Unsere neusten Resultate zeigen, dass Krebszellen ein spezialisiertes Spleissosom, das so genannte Minor-Spleissosom, nutzen um krebsrelevante mRNAs zu vermehren. Krebs macht sich also die Minor-Intron-Spleissmaschinerie zunutze, um die Expression von Minor-Intron-enthaltenden Transkripten zu steigern. Von Minor-Intron-Genen kodierte Proteine scheinen speziell für das Überleben der Zelle (z.B. Regulierung des Zellzyklus oder DNA-Reparatur) wichtige Gene zu aktivieren. Die Ausnutzung dieser Abhängigkeit der Krebszellen von Minor-Intron-enthaltenden Genen stellt eine neue therapeutische Möglichkeit der gezielten Krebsbekämpfung dar. Durch Hemmung des Minor-Spleissosoms können wir selektiv den Zelltod in Krebszellen auslösen, während gesunde Nachbarzellen verschont bleiben.