Spatial Analysis
Forschungsprojekte
Eine personalisierte Multi-omics-Entdeckungs- und Validierungsplattform für rezidivierende Plattenepithelkarzinome im Kopf- und Halsbereich
Gruppe Giger Head and Neck Anticancer Center, POLARES Research Group
Die diagnostischen und therapeutischen Entwicklungen der letzten Jahre haben die Prognose für Patienten mit Kopf-Hals-Plattenepithelkarzinomen (KH-PE-Karzinom) verbessert. Trotz dieser Entwicklungen erleidet ein erheblicher Anteil der Patienten, nach einem ersten Ansprechen auf die Standardbehandlung, einen Rückfall. Die Möglichkeiten einer Zweit-Behandlung sind beschränkt, und es fehlt an personalisierten Behandlungsansätzen, die die genomische/ epigenetische Landschaft des Tumors berücksichtigen.
Ziel dieser Studie ist es, ein Exzellenzzentrum für KH-PE-Karzinome einzurichten, das die Lücke zwischen genomischer Analyse und Umsetzung der Ergebnisse in klinische Studien schliesst. Durch die Etablierung einer Multi-omics-Entdeckungs- und Validierungsplattform, unter dem Dach des University Comprehensive Cancer Center Inselspital (UCI), will dieses Konsortium (HNO, Kopf- und Halschirurgie; Medizinische Onkologie; Radio-Onkologie) herausfinden, wie Veränderungen auf genomischer und epigenetischer Ebene die Karzinom-Entstehung, das Ansprechen auf die Behandlung und die Resistenz bei KH-PE-Karzinomen regulieren und dadurch neue Mechanismen zur Bekämpfung von Wiederauftreten identifizieren.
Im Namen des Konsortiums: Prof. Dr. Roland Giger (Lead), Otorhinolaryngology, Head and Neck Surgery; PD Dr. Olgun Eliçin, Radio-Oncology; Dr. Simon Häfliger, Medical Oncology; PD Dr. Michaela Medová, Radio-Oncology, DBMR; Prof. Dr. Carsten Riether, Medical Oncology, DBMR; Dr. Daniel H. Schanne, Radio-Oncology
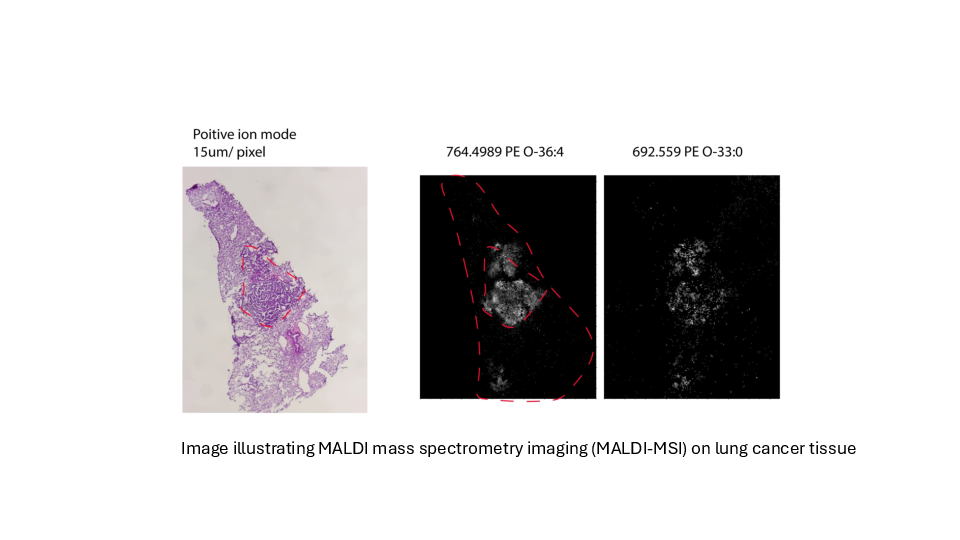
Bestimmung der Tumorlipidheterogenität bei Lungenkrebs
Gruppe Konstantinidou PD. Dr. Georgia Konstantinidou, PhD
Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Tumorassoziierte Mutationen von KRAS treten bei etwa 30 Prozent des nicht-kleinzelligen Lungenkrebses auf, der häufigsten Form von Lungenkrebs.
KRAS-Mutationen sind sowohl beim Menschen als auch in Mausmodellen mit aggressiven, metastasierenden und therapieresistenten Krebsarten assoziiert. Mutiertes KRAS treibt ein komplexes Netzwerk von Lipidstoffwechselumlagerungen an, um die Anpassung von Krebszellen an Hypoxie zu unterstützen und ihr Überleben zu sichern.
Wir planen, die transkriptomischen und lipidomischen Veränderungen zu bestimmen, die in Lungentumoren während der Krebsprogression und der Therapieresistenz auftreten, und ihre funktionelle Bedeutung zu untersuchen. Dabei berücksichtigen wir die Tumor-zu-Tumor-Heterogenität und bewahren zugleich die räumliche Organisation der Krebszellpopulationen innerhalb des Tumormikromilieus.
Zielgerichtete Untersuchungen des Zellstoffwechsels zur Verbesserung der Krebstherapie
Gruppe Marti PD Dr. Thomas Michael Marti
In diesem Projekt wird untersucht, wie der Nukleotid-/Laktat-Stoffwechsel und die DNA-Schadens-Reparatur-Maschinerie mit der Fähigkeit zur Tumorbildung, dem Ansprechen auf Chemotherapien und zur Metastasierung von Lungen- und Mesotheliom-Krebsstammzellen zusammenhängen. Darüber hinaus nutzen wir therapieinduzierte, zelluläre Anpassungen als neue Angriffspunkte für die Krebstherapie.