Transkriptomik
Forschungsprojekte
Verstehen der Rolle des Ribonuklease-Inhibitors (RNH1) bei Myelopoese und myeloischen Malignomen
Gruppe Allam Prof. Dr. phil. nat. Ramanjaneyulu Allam
In früheren Untersuchungen wurde festgestellt, dass der Ribonuklease-Inhibitor (RNH1) eine bedeutende Rolle bei der Regulation der Hämatopoese spielt. Die Abwesenheit von RNH1 führt zu einer Verschiebung des Gleichgewichts zugunsten der Myelopoese auf Kosten der Erythropoese und Lymphopoese. Beobachtungen in in-vivo Mäusestudien zeigten zudem, dass trotz einer erhöhten Myelopoese keine leukämische Transformation stattfindet.
Ziel des gegenwärtigen Projektes ist es, den Mechanismus der RNH1 regulierter Verschlechterung der Myelopoese unter homöostatischen Bedingungen zu ergründen. Des Weiteren soll die Auswirkung genetisch veränderter RNH1-Expression auf myeloischen Malignome ermittelt werden. Hierfür werden AML in-vitro- (Zelllinien) und in-vivo-Modelle (Mäuse) sowie Zellen von AML-Patienten verwendet.
Unsere bisherigen Forschungen haben gezeigt, dass RNH1 an der Pathophysiologie von AML beteiligt ist. Zusätzlich wird in laufenden Studien versucht, das therapeutische Potenzial eines gezielten Angriffs an RNH1 bei myeloischen Malignomen zu untersuchen.
Eine personalisierte Multi-omics-Entdeckungs- und Validierungsplattform für rezidivierende Plattenepithelkarzinome im Kopf- und Halsbereich
Gruppe Giger Head and Neck Anticancer Center, POLARES Research Group
Die diagnostischen und therapeutischen Entwicklungen der letzten Jahre haben die Prognose für Patienten mit Kopf-Hals-Plattenepithelkarzinomen (KH-PE-Karzinom) verbessert. Trotz dieser Entwicklungen erleidet ein erheblicher Anteil der Patienten, nach einem ersten Ansprechen auf die Standardbehandlung, einen Rückfall. Die Möglichkeiten einer Zweit-Behandlung sind beschränkt, und es fehlt an personalisierten Behandlungsansätzen, die die genomische/ epigenetische Landschaft des Tumors berücksichtigen.
Ziel dieser Studie ist es, ein Exzellenzzentrum für KH-PE-Karzinome einzurichten, das die Lücke zwischen genomischer Analyse und Umsetzung der Ergebnisse in klinische Studien schliesst. Durch die Etablierung einer Multi-omics-Entdeckungs- und Validierungsplattform, unter dem Dach des University Comprehensive Cancer Center Inselspital (UCI), will dieses Konsortium (HNO, Kopf- und Halschirurgie; Medizinische Onkologie; Radio-Onkologie) herausfinden, wie Veränderungen auf genomischer und epigenetischer Ebene die Karzinom-Entstehung, das Ansprechen auf die Behandlung und die Resistenz bei KH-PE-Karzinomen regulieren und dadurch neue Mechanismen zur Bekämpfung von Wiederauftreten identifizieren.
Im Namen des Konsortiums: Prof. Dr. Roland Giger (Lead), Otorhinolaryngology, Head and Neck Surgery; PD Dr. Olgun Eliçin, Radio-Oncology; Dr. Simon Häfliger, Medical Oncology; PD Dr. Michaela Medová, Radio-Oncology, DBMR; Prof. Dr. Carsten Riether, Medical Oncology, DBMR; Dr. Daniel H. Schanne, Radio-Oncology
Nicht-kodierende RNAs (ncRNAs) bei Lungenkrebs
Gruppe Häfliger Dr. med. et phil. nat. Simon Häfliger
Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Unsere Forschung beschäftigt sich mit der faszinierenden Welt der nicht-kodierenden RNAs (ncRNAs), RNA-Moleküle, die nicht in Proteine übersetzt werden.
- Micro-RNAs (miRNAs): Diese winzigen RNA-Moleküle können entweder als Tumorsuppressoren oder als Onkogene wirken und die Krebsentwicklung beeinflussen.
- Long non-coding RNAs (lncRNAs): Diese längeren RNA-Moleküle beeinflussen die Genexpression und sind von zentraler Bedeutung für die epigenetische Regulierung.
Mittels öffentlicher Datenbanken, Blut von Lungenkrebspatienten, Krebszelllinien und bioinformatischen Analysen untersuchen wir ncRNAs mit der Fragestellung:
- Diagnostische Biomarker: Können zirkulierende ncRNAs als Frühindikatoren für Lungenkrebs dienen?
- Mechanismus: Wie beeinflussen diese ncRNAs das Fortschreiten von Krebs?
- Prädiktive und prognostische Marker: Können sie bei Behandlungsentscheidungen helfen?
Die Ergebnisse dieser Analysen versuchen wir in praktische klinische Anwendungen zu übersetzen, um Behandlungstrategien und damit das Überleben von Patientinnen und Patienten zu verbessern.
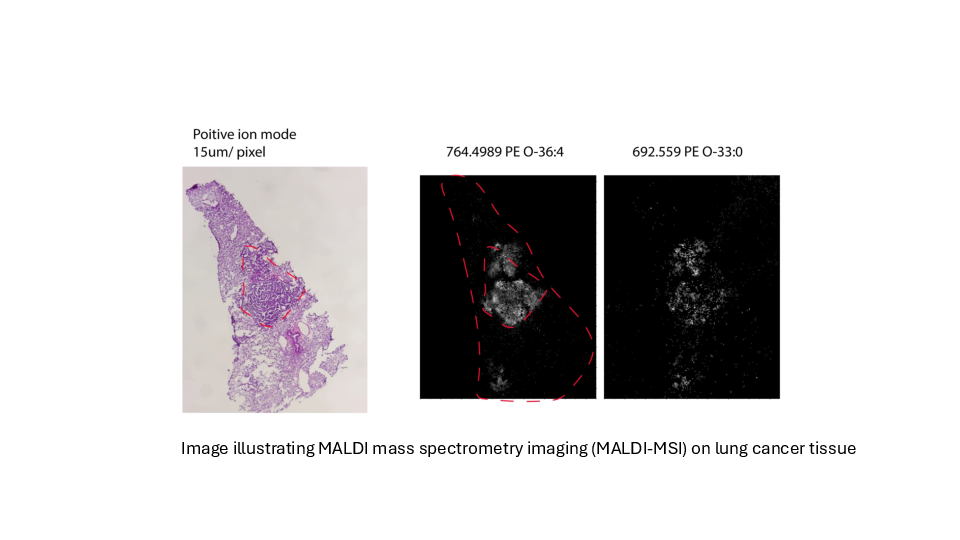
Bestimmung der Tumorlipidheterogenität bei Lungenkrebs
Gruppe Konstantinidou PD. Dr. Georgia Konstantinidou, PhD
Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Tumorassoziierte Mutationen von KRAS treten bei etwa 30 Prozent des nicht-kleinzelligen Lungenkrebses auf, der häufigsten Form von Lungenkrebs.
KRAS-Mutationen sind sowohl beim Menschen als auch in Mausmodellen mit aggressiven, metastasierenden und therapieresistenten Krebsarten assoziiert. Mutiertes KRAS treibt ein komplexes Netzwerk von Lipidstoffwechselumlagerungen an, um die Anpassung von Krebszellen an Hypoxie zu unterstützen und ihr Überleben zu sichern.
Wir planen, die transkriptomischen und lipidomischen Veränderungen zu bestimmen, die in Lungentumoren während der Krebsprogression und der Therapieresistenz auftreten, und ihre funktionelle Bedeutung zu untersuchen. Dabei berücksichtigen wir die Tumor-zu-Tumor-Heterogenität und bewahren zugleich die räumliche Organisation der Krebszellpopulationen innerhalb des Tumormikromilieus.
Entschlüsselung der Rolle der Heterogenität von Tumorzellen bei der Progression von neuroendokrinen Tumoren des Pankreas
Gruppe Marinoni Perren Sadowski PD Dr. Ilaria Marinoni, PhD, Prof. Dr. med. Aurel Perren, PD Dr. Martin Sadowski, PhD
Krebs ist eine dynamische Krankheit; genetische und epigenetische Veränderungen führen zu einer Heterogenität der Zellen innerhalb des Tumors, was zur Auswahl aggressiver Zellpopulationen führt, die das Fortschreiten der Krankheit und schliesslich die Metastasierung vorantreiben können.
Neuroendokrine Tumore der Bauchspeicheldrüse (PanNETs) sind Tumore, die von Zellen der Langerhans-Inseln stammen. Sie weisen eine intra-tumorale Zellheterogenität auf. Aber es ist unklar, wie diese während der Tumorentwicklung entsteht und sich entwickelt.
Unsere bisherigen Daten deuten darauf hin, dass epigenetische Veränderungen die Hauptursache für die Progression und Zellheterogenität bei PanNETs sind. Durch die Integration von epigenetischen und transkriptomischen Profilen konnten wir feststellen, dass die Dedifferenzierung von Zellen und metabolische Veränderungen das Fortschreiten von kleinen PanNETs zu fortgeschrittenen PanNETs charakterisieren.
Derzeit untersuchen wir die Entwicklung der intra-tumoralen Heterogenität von PanNETs über Raum und Zeit hinweg. Spezifische Zellsubpopulationen, die als treibende Kraft des Fortschreitens identifiziert wurden, könnten dann gezielt therapeutisch angegangen werden, um die Metastasenbildung zu stoppen.
Zielgerichtete Untersuchungen des Zellstoffwechsels zur Verbesserung der Krebstherapie
Gruppe Marti PD Dr. Thomas Michael Marti
In diesem Projekt wird untersucht, wie der Nukleotid-/Laktat-Stoffwechsel und die DNA-Schadens-Reparatur-Maschinerie mit der Fähigkeit zur Tumorbildung, dem Ansprechen auf Chemotherapien und zur Metastasierung von Lungen- und Mesotheliom-Krebsstammzellen zusammenhängen. Darüber hinaus nutzen wir therapieinduzierte, zelluläre Anpassungen als neue Angriffspunkte für die Krebstherapie.
Die Interaktion von Immunzellen mit Leukämie- und Krebs-Stammzellen
Gruppe Ochsenbein Prof. Dr. med. Adrian Ochsenbein
Unsere Forschungseinheit untersucht die Wechselwirkung zwischen Immunzellen und Krebsstammzellen mit Schwerpunkt auf Leukämiestammzellen. Krebsstammzellen sind gegen die meisten der derzeit verfügbaren Medikamente resistent und für Rückfälle nach einer erfolgreichen Chemotherapie verantwortlich.
Wir setzen modernste Techniken ein, um die molekularen Interaktionen zwischen Immunzellen und Krebsstammzellen in Mausmodellen und in klinischen Proben von Krebspatienten zu analysieren.
Ziel ist die Entwicklung verbesserter Immuntherapien, die speziell auf Krebsstammzellen abzielen, insbesondere für hämatoonkologische Erkrankungen wie Leukämie und multiples Myelom. Diese neuartigen Medikamente werden in präklinischen Modellen und in klinischen Phasen 1 und 2 Studien getestet.
Künstliche Intelligenz zur automatisierten Qualitätssicherung in der Radiotherapie für das Glioblastom-Zielvolumen und die Abgrenzung gefährdeter Organe in klinischen Studien – AQUA RT
Gruppe Reyes Prof. Dr. Mauricio Reyes
In diesem Projekt wollen wir die Hypothese testen, dass KI-basierte Auto-Segmentierungstechnologien für eine KI-gestützte multikriterielle Qualitätssicherungsbewertung in der Strahlentherapie.
Das vorgeschlagene multikriterielle Bewertungsmodell soll eine objektivere Bewertung als herkömmliche Ansätze ermöglichen und gleichzeitig gleichzeitig auf klinisch relevante Aspekte der Strahlentherapie fokussiert werden. Das vorgeschlagene Automated QUality Assurance in RadioTherapy (AQUA-RT) hat das Potenzial, die Konsistenz zu erhöhen, die Abgrenzungsqualität zu verbessern und den Arbeitsaufwand für routinemässig anspruchsvolle Qualitätssicherungsverfahren zu verringern.
Bild: Mauricio Reyes
Leukamiestammzellen und die umgebenden Strukturen im Knochenmark
Gruppe Riether Prof. Carsten Riether, PhD
Das Knochenmark ist eine einzigartige zelluläre Architektur, die das Selbsterneuerungs- und Differenzierungspotenzial von hämatopoetischen Stamm- und Vorläuferzellen durch Zell-Zell-Interaktionen oder die Freisetzung löslicher Mediatoren entscheidend reguliert.
Diese evolutionär konservierten Prozesse, die sich entwickelt haben, um normale hämatopoetische Stammzellen vor der Eliminierung zu schützen und bedarfsangepasste Reaktionen bei Entzündungen zu regulieren, werden bei Krebs und Leukämie häufig unterwandert.
Ziel unserer Forschung ist es, die molekularen und zellulären Mechanismen zu verstehen, mit denen verschiedene Komponenten des Knochenmarks, wie Immunzellen und Stromazellen, krankheitsauslösende und -erhaltende Leukämiestammzellen (LSCs) beeinflussen und sie vor der immunvermittelten Eliminierung zu schützen.
Wir nutzen modernste Technologien, etablierte Mausmodelle für chronische und akute myeloische Leukämie sowie Xenotransplantationsmodelle, um unser Verständnis von LSCs zu vertiefen und unsere Erkenntnisse auf menschliche Erkrankungen zu übertragen.