Zellbiologie
Forschungsprojekte
Verstehen der Rolle des Ribonuklease-Inhibitors (RNH1) bei Myelopoese und myeloischen Malignomen
Gruppe Allam Prof. Dr. phil. nat. Ramanjaneyulu Allam
In früheren Untersuchungen wurde festgestellt, dass der Ribonuklease-Inhibitor (RNH1) eine bedeutende Rolle bei der Regulation der Hämatopoese spielt. Die Abwesenheit von RNH1 führt zu einer Verschiebung des Gleichgewichts zugunsten der Myelopoese auf Kosten der Erythropoese und Lymphopoese. Beobachtungen in in-vivo Mäusestudien zeigten zudem, dass trotz einer erhöhten Myelopoese keine leukämische Transformation stattfindet.
Ziel des gegenwärtigen Projektes ist es, den Mechanismus der RNH1 regulierter Verschlechterung der Myelopoese unter homöostatischen Bedingungen zu ergründen. Des Weiteren soll die Auswirkung genetisch veränderter RNH1-Expression auf myeloischen Malignome ermittelt werden. Hierfür werden AML in-vitro- (Zelllinien) und in-vivo-Modelle (Mäuse) sowie Zellen von AML-Patienten verwendet.
Unsere bisherigen Forschungen haben gezeigt, dass RNH1 an der Pathophysiologie von AML beteiligt ist. Zusätzlich wird in laufenden Studien versucht, das therapeutische Potenzial eines gezielten Angriffs an RNH1 bei myeloischen Malignomen zu untersuchen.
CAR-T-Zellen der nächsten Generation für pädiatrische solide Tumoren
Gruppe Bernasconi Furtwängler Prof. Dr. Michele Bernasconi
Wir wollen bestehende Therapien für pädiatrische solide Tumoren verbessern und neue, wirksamere und weniger toxische Behandlungsstrategien entwickeln, mit einem besonderen Fokus auf das Rhabdomyosarkom und den Wilms-Tumor. Pädiatrische Sarkome machen etwa 15 % aller Krebserkrankungen im Kindesalter aus. Die Rückfallrate ist allgemein hoch und die Prognose äusserst ungünstig.
Das Rhabdomyosarkom (RMS) ist das häufigste Weichteilsarkom bei Kindern. Es werden zwei prognostisch relevante Hauptgruppen unterschieden: fusion-negatives (FN) RMS, das bei ca. 55 % der Patient:innen vorkommt und mit einem ereignisfreien 5-Jahres-Überleben von etwa 70 % verbunden ist, sowie fusion-positives (FP) RMS, das bei rund 20 % der Patient:innen auftritt und ein deutlich schlechteres ereignisfreies 5-Jahres-Überleben von nur etwa 23 % aufweist.
Der Wilms-Tumor (WT), oder Nephroblastom, ist der häufigste Nierentumor im Kindesalter. Zwar ist heutzutage bei der Mehrzahl der betroffenen Kinder eine kurative Therapie möglich, doch Patient:innen mit Hochrisikotumoren (blastemal oder anaplastisch) haben eine signifikant schlechtere Überlebensrate. Darüber hinaus sind die derzeitigen Standardtherapien mit erheblichen Langzeitfolgen verbunden, darunter sekundäre Neoplasien, Herzinsuffizienz, Unfruchtbarkeit und Nierenerkrankungen.
CAR-T-Zellen sind gentechnisch veränderte T-Lymphozyten, die chimäre Antigenrezeptoren (CARs) exprimieren. Die CAR-T-Zelltherapie gilt als einer der vielversprechendsten Ansätze zur Behandlung von rezidivierten oder anderweitig nicht behandelbaren Krebserkrankungen.
Seit 2018 konzentriert sich unser Labor auf diese personalisierte Immuntherapie, um die Fähigkeit des Immunsystems der Patient:innen zu stärken, Tumorzellen zu erkennen und zu bekämpfen. Mittels Proteomik untersuchen wir das Surfaceom, um neue Zielstrukturen für CAR-T-Zellen zu identifizieren. Anschliessend führen wir In-vitro- und In-vivo-Studien durch, um die Aktivität und therapeutische Wirksamkeit von CAR-T-Zellen zu verbessern.
Perspektiven der gezielten Radionuklid-Bildgebung und -Therapie des Fibroblasten-Aktivierungsproteins (FAP) bei Krebs
Gruppe Gourni PD Dr. Eleni Gourni
Tumore entwickeln sich in einer komplexen Mikroumgebung aus verschiedenen Zelltypen, umgeben von einer proteinreichen Matrix namens Tumorstroma. Krebszellen sind auf diese Unterstützung angewiesen, um zu überleben, zu wachsen und anderes Gewebe zu befallen.
Das Stroma, bestehend aus Immunzellen, Fibroblasten und Endothelzellen, ist daher ein potenzielles Ziel für Krebstherapien. Die Bekämpfung von FAP, einem überexprimierten Protein bei verschiedenen Tumortypen, könnte eine nützliche Strategie zur Verhinderung von Tumorwachstum sein.
Das aktuelle Projekt zielt darauf ab, neuartige FAP-spezifische Inhibitoren zu entwerfen und zu evaluieren, um Radiotracer zu generieren, die für die Diagnose und Behandlung von FAP-positiven Tumoren eingesetzt werden können. Die neuartigen Radiotracer werden gründlich in vitro und in vivo an Zelllinien und xenograftierten Tumormodellen untersucht, um ihre Bindungseigenschaften und ihre in vivo Leistung zu verstehen.
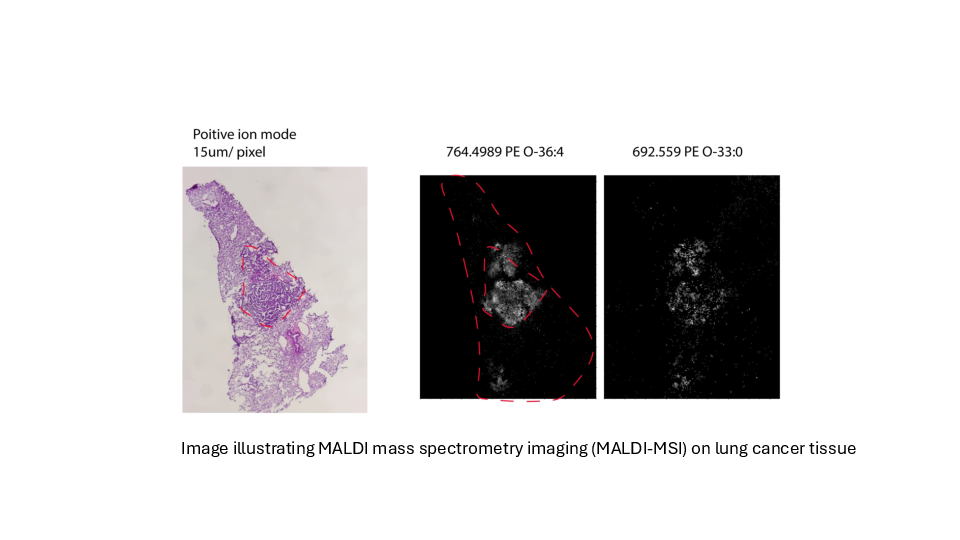
Bestimmung der Tumorlipidheterogenität bei Lungenkrebs
Gruppe Konstantinidou PD. Dr. Georgia Konstantinidou, PhD
Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Tumorassoziierte Mutationen von KRAS treten bei etwa 30 Prozent des nicht-kleinzelligen Lungenkrebses auf, der häufigsten Form von Lungenkrebs.
KRAS-Mutationen sind sowohl beim Menschen als auch in Mausmodellen mit aggressiven, metastasierenden und therapieresistenten Krebsarten assoziiert. Mutiertes KRAS treibt ein komplexes Netzwerk von Lipidstoffwechselumlagerungen an, um die Anpassung von Krebszellen an Hypoxie zu unterstützen und ihr Überleben zu sichern.
Wir planen, die transkriptomischen und lipidomischen Veränderungen zu bestimmen, die in Lungentumoren während der Krebsprogression und der Therapieresistenz auftreten, und ihre funktionelle Bedeutung zu untersuchen. Dabei berücksichtigen wir die Tumor-zu-Tumor-Heterogenität und bewahren zugleich die räumliche Organisation der Krebszellpopulationen innerhalb des Tumormikromilieus.
Entschlüsselung der Rolle der Heterogenität von Tumorzellen bei der Progression von neuroendokrinen Tumoren des Pankreas
Gruppe Marinoni Perren Sadowski PD Dr. Ilaria Marinoni, PhD, Prof. Dr. med. Aurel Perren, PD Dr. Martin Sadowski, PhD
Krebs ist eine dynamische Krankheit; genetische und epigenetische Veränderungen führen zu einer Heterogenität der Zellen innerhalb des Tumors, was zur Auswahl aggressiver Zellpopulationen führt, die das Fortschreiten der Krankheit und schliesslich die Metastasierung vorantreiben können.
Neuroendokrine Tumore der Bauchspeicheldrüse (PanNETs) sind Tumore, die von Zellen der Langerhans-Inseln stammen. Sie weisen eine intra-tumorale Zellheterogenität auf. Aber es ist unklar, wie diese während der Tumorentwicklung entsteht und sich entwickelt.
Unsere bisherigen Daten deuten darauf hin, dass epigenetische Veränderungen die Hauptursache für die Progression und Zellheterogenität bei PanNETs sind. Durch die Integration von epigenetischen und transkriptomischen Profilen konnten wir feststellen, dass die Dedifferenzierung von Zellen und metabolische Veränderungen das Fortschreiten von kleinen PanNETs zu fortgeschrittenen PanNETs charakterisieren.
Derzeit untersuchen wir die Entwicklung der intra-tumoralen Heterogenität von PanNETs über Raum und Zeit hinweg. Spezifische Zellsubpopulationen, die als treibende Kraft des Fortschreitens identifiziert wurden, könnten dann gezielt therapeutisch angegangen werden, um die Metastasenbildung zu stoppen.
Zielgerichtete Untersuchungen des Zellstoffwechsels zur Verbesserung der Krebstherapie
Gruppe Marti PD Dr. Thomas Michael Marti
In diesem Projekt wird untersucht, wie der Nukleotid-/Laktat-Stoffwechsel und die DNA-Schadens-Reparatur-Maschinerie mit der Fähigkeit zur Tumorbildung, dem Ansprechen auf Chemotherapien und zur Metastasierung von Lungen- und Mesotheliom-Krebsstammzellen zusammenhängen. Darüber hinaus nutzen wir therapieinduzierte, zelluläre Anpassungen als neue Angriffspunkte für die Krebstherapie.
Onkogene Signalwege von Rezeptortyrosinkinasen im Zusammenspiel mit DNA-Schadensreaktion
Gruppe Medová PD Dr. Michaela Medová
Tyrosinkinase-Rezeptoren aktivieren eine Vielzahl unterschiedlicher zellulärer Signalwege. Physiologisch ist eine intakte Signalübertragung über den MET-Rezeptor für die Embryonalentwicklung und die Gewebehomöostase unverzichtbar. Gleichzeitig fördert eine MET-Dysregulation Merkmale, die eindeutig mit Tumorwachstum und -progression verbunden sind, wie z. B. unkontrollierte Proliferation, Angiogenese, lokale Invasion und systemische Verbreitung.
Immer mehr Daten deuten darauf hin, dass die MET-Signalübertragung Tumorzellen auch vor DNA-Schäden schützen kann, was ihre abnormale Aktivität mit der Resistenz gegen DNA-schädigende Wirkstoffe in Verbindung bringt, die routinemässig bei der Krebsbehandlung eingesetzt werden.
Wir haben eine bisher unbekannte Phosphorylierungsstelle auf MET identifiziert, die von DNA-Schadens-Masterkinasen erkannt werden kann und nicht nur an zellulären Reaktionen auf DNA-Schäden, sondern auch an Metastasierungsprozessen, der Migration von Krebszellen und dem verankerungsunabhängigen Wachstum beteiligt ist.
Ziel dieses Projekts ist es, die Natur, Funktion und Regulation dieser Phosphorylierungsstelle bei der onkogenen Signalübertragung des Rezeptors zu untersuchen.
Myeloische Malignome
Gruppe Meyer Prof. Dr. med. Sara C. Meyer
Myeloproliferative Neoplasien (MPN) sind chronische Leukämien. Sie sind durch eine konstitutive Aktivierung des JAK2 Tyrosinkinase-Signaling gekennzeichnet. JAK2 Inhibitoren stellen einen Standard in der Behandlung dar, haben aber nur einen begrenzte krankheitsmodizierenden Effekt. Die allogene hämatopoietische Stammzelltransplantation ist bisher der einzige Therapieansatz mit kurativem Potential.
Mein Forschungsteam untersucht das onkogene Signaling, das den MPN zugrunde liegt. Wir konnten zeigen, dass die Aktivierung des MAPK Signaling, eines Pathways, der bei verschiedenen Krebsarten eine wichtige Rolle spielt, bei MPN die Wirksamkeit der JAK2 Inhibitor-Behandlung vermindert und gezielt angegangen werden muss (Stivala, JCI 2019; Brkic Leukemia 2021).
Das hat Eingang in eine klinische Studie gefunden (Adore, NCT04097821). Weiter untersucht mein Forschungsteam Resistenzmechanismen, die zu Verlust des Therapieansprechens auf die JAK2 Inhibitoren führen. Insbesondere sind wir involviert in die Entwicklung neuer JAK2 Inhibitoren mit verbesserter Wirksamkeit bei MPN, die sich in Entwicklung zu klinischen Studien befinden (Meyer, Cancer Cell 2015; Codilupi, CCR 2024).
Die Interaktion von Immunzellen mit Leukämie- und Krebs-Stammzellen
Gruppe Ochsenbein Prof. Dr. med. Adrian Ochsenbein
Unsere Forschungseinheit untersucht die Wechselwirkung zwischen Immunzellen und Krebsstammzellen mit Schwerpunkt auf Leukämiestammzellen. Krebsstammzellen sind gegen die meisten der derzeit verfügbaren Medikamente resistent und für Rückfälle nach einer erfolgreichen Chemotherapie verantwortlich.
Wir setzen modernste Techniken ein, um die molekularen Interaktionen zwischen Immunzellen und Krebsstammzellen in Mausmodellen und in klinischen Proben von Krebspatienten zu analysieren.
Ziel ist die Entwicklung verbesserter Immuntherapien, die speziell auf Krebsstammzellen abzielen, insbesondere für hämatoonkologische Erkrankungen wie Leukämie und multiples Myelom. Diese neuartigen Medikamente werden in präklinischen Modellen und in klinischen Phasen 1 und 2 Studien getestet.
Genetische Varianten der Immunregulatoren als Response Biomarker bei B-Zell Lymphomen mit CAR-T Zell Therapie
Gruppe Pabst & Seipel Prof. Dr. med. Thomas Pabst, PD Dr. Katja Seipel
Seit 2020 werden am Inselspital Patienten mit B-Zell Lymphomen mit CAR-T Zell Therapie behandelt. Wir evaluieren das unterschiedliche Ansprechen auf CAR-T Zell Therapie und suchen Response Biomarker, die auf erfolgreiche Behandlung hinweisen können.
Gezielte Bekämpfung metabolischer Superkomplexe bei therapieresistentem Prostatakrebs
Gruppe Pandey Prof. Dr. phil. Amit V. Pandey
Das kastrationsresistente Prostatakarzinom (CRPC) stellt ein tödliches Stadium der Erkrankung dar, das hauptsächlich dadurch vorangetrieben wird, dass der Tumor die Fähigkeit entwickelt, Therapien durch die Synthese eigener Androgene zu überwinden.
Unsere Forschung geht über die Untersuchung einzelner Enzyme hinaus und erforscht deren übergeordnete Organisation in sogenannten «metabolischen Superkomplexen» oder «Metabolons». Unsere zentrale Hypothese ist, dass Schlüsselenzyme der Androgenproduktion, wie CYP17A1, AKR1C3 und STS, nicht isoliert funktionieren. Stattdessen bilden sie organisierte Multi-Protein-Komplexe an der Schnittstelle von Zellkompartimenten, wie dem Endoplasmatischen Retikulum und dem Zytosol. Diese Superkomplexe agieren als hocheffiziente Produktionslinien und nutzen einen Mechanismus, der als «Substrat-Channeling» bezeichnet wird, um Vorläuferstoffe schnell in potente Androgene umzuwandeln, die das Krebswachstum antreiben.
Dieses Modell liefert eine überzeugende neue Erklärung für die robuste Resistenz, die gegen Medikamente wie Abirateron beobachtet wird. Unsere aktuelle Arbeit konzentriert sich auf die Charakterisierung der Struktur und Funktion dieser Superkomplexe. Das Endziel ist die Entwicklung innovativer Therapiestrategien, die nicht nur Schlüsselenzyme hemmen, sondern auch die entscheidenden Protein-Protein-Wechselwirkungen stören, die diese metabolischen Maschinen zusammenhalten, möglicherweise unter Verwendung neuartiger niedermolekularer Wirkstoffe oder fortschrittlicher nanopartikelbasierter Verabreichungssysteme.
Leukamiestammzellen und die umgebenden Strukturen im Knochenmark
Gruppe Riether Prof. Carsten Riether, PhD
Das Knochenmark ist eine einzigartige zelluläre Architektur, die das Selbsterneuerungs- und Differenzierungspotenzial von hämatopoetischen Stamm- und Vorläuferzellen durch Zell-Zell-Interaktionen oder die Freisetzung löslicher Mediatoren entscheidend reguliert.
Diese evolutionär konservierten Prozesse, die sich entwickelt haben, um normale hämatopoetische Stammzellen vor der Eliminierung zu schützen und bedarfsangepasste Reaktionen bei Entzündungen zu regulieren, werden bei Krebs und Leukämie häufig unterwandert.
Ziel unserer Forschung ist es, die molekularen und zellulären Mechanismen zu verstehen, mit denen verschiedene Komponenten des Knochenmarks, wie Immunzellen und Stromazellen, krankheitsauslösende und -erhaltende Leukämiestammzellen (LSCs) beeinflussen und sie vor der immunvermittelten Eliminierung zu schützen.
Wir nutzen modernste Technologien, etablierte Mausmodelle für chronische und akute myeloische Leukämie sowie Xenotransplantationsmodelle, um unser Verständnis von LSCs zu vertiefen und unsere Erkenntnisse auf menschliche Erkrankungen zu übertragen.
Krebszellenmigration basierend auf onkogen-induzierter Autophagie
Gruppe Tschan Prof. Dr. phil. nat. Mario Tschan
Wir haben eine onkogene Spleissvariante des Tumorsuppressor und Transkriptionsfaktors DMTF1 entdeckt. DMTF1 ist ein positiver Regulator des p53 Signalweges. Diese onkogene Spleissvariante, DMTF1β, erhӧht die Migration von Krebszellen mittels Aktivierung der Autophagie.
Aktuell untersuchen wir die Mechanismen, welche für die Regulation dieses neuen Onkogens verantwortlich sind, und wie DMTF1β die maligne Zellmigration mittels Autophagie steuert.
Unser Ziel ist es herauszufinden, welche Tumorarten unter welchen Umweltbedingungen von einer Kombinationstherapie mit gӓngigen Krebstherapien und der Blockierung der Autophagie, mit dem die Zellmigration einzudӓmmen, profitieren kӧnnen.
Nonsense-mediated mRNA decay, die Achillesferse des rezidivierenden Glioblastoms?
Gruppe Vassella Prof. Dr. Erik Vassella
Zum Nachweis von Temozolomid-Resistenzgenen haben wir CRISPR/CAS-Interferenzbibliotheken gescreent und SMG1 identifiziert, das an einem evolutionär konservierten RNA-Qualitätskontrollweg beteiligt ist - dem Nonsense-mediated mRNA decay (NMD).
Die Funktion von NMD ist, Transkripte zu unterdrücken, welche prämature Stoppcodons enthalten. NMD kann zudem DNA-Reparatur-Prozesse in der Zelle beeinflussen und auf diese Weise die Zelle vor DNA-Schädigung, ausgelöst durch eine Behandlung mit Temozolomid, schützen. Tunkierende Proteine werden vermehrt durch eine SMG1 Attenuation exprimiert; diese sind in der Regel sehr immunogen.
Wir untersuchen, ob eine Tumorentzündung in Glioblastom-Rezidiven durch die Hemmung des NMD Pathways auslöst werden kann. Dieses Projekt könnte klinisch relevant sein, da eine Hemmung des NMD Pathways das Ansprechen auf die Behandlung mit Immun-Checkpoint-Inhibitoren verbessern könnte. Diese Arbeit wird derzeit von der Krebsliga Schweiz unterstützt.