Lunge und Trachea
Forschungsprojekte
Perspektiven der gezielten Radionuklid-Bildgebung und -Therapie des Fibroblasten-Aktivierungsproteins (FAP) bei Krebs
Gruppe Gourni PD Dr. Eleni Gourni
Tumore entwickeln sich in einer komplexen Mikroumgebung aus verschiedenen Zelltypen, umgeben von einer proteinreichen Matrix namens Tumorstroma. Krebszellen sind auf diese Unterstützung angewiesen, um zu überleben, zu wachsen und anderes Gewebe zu befallen.
Das Stroma, bestehend aus Immunzellen, Fibroblasten und Endothelzellen, ist daher ein potenzielles Ziel für Krebstherapien. Die Bekämpfung von FAP, einem überexprimierten Protein bei verschiedenen Tumortypen, könnte eine nützliche Strategie zur Verhinderung von Tumorwachstum sein.
Das aktuelle Projekt zielt darauf ab, neuartige FAP-spezifische Inhibitoren zu entwerfen und zu evaluieren, um Radiotracer zu generieren, die für die Diagnose und Behandlung von FAP-positiven Tumoren eingesetzt werden können. Die neuartigen Radiotracer werden gründlich in vitro und in vivo an Zelllinien und xenograftierten Tumormodellen untersucht, um ihre Bindungseigenschaften und ihre in vivo Leistung zu verstehen.
Metastasis-on-Chip Modell
Gruppe Guenat Prof. Dr. Olivier T. Guenat
Das Metastasis-on-Chip-Projekt zielt darauf ab, den metastatischen Prozess zu replizieren, wobei der Schwerpunkt auf der Extravasation und der Koloniebildung liegt.
Unsere ersten Studien bewerten das metastatische Potenzial von Krebszellen basierend auf ihren Phänotypen, wobei wir die A549-Zelllinie für nicht-kleinzelliges Lungenkarzinom (NSCLC) verwenden, die unterschiedliche phänotypische Variationen aufweist. Wir haben festgestellt, dass Paraclone, die durch einen mesenchymalen Phänotyp gekennzeichnet sind, erfolgreich extravasieren, während Holoclone mit einem epithelialen Phänotyp dies nicht tun. Darüber hinaus zeigten Paraclone ein signifikant höheres Migrationsverhalten im Vergleich zu Holoclone.
Diese Erkenntnisse liefern wertvolle Einblicke in die Mechanismen der Metastase und legen den Grundstein für weitere Untersuchungen gezielter Therapien.
Nicht-kodierende RNAs (ncRNAs) bei Lungenkrebs
Gruppe Häfliger Dr. med. et phil. nat. Simon Häfliger
Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Unsere Forschung beschäftigt sich mit der faszinierenden Welt der nicht-kodierenden RNAs (ncRNAs), RNA-Moleküle, die nicht in Proteine übersetzt werden.
- Micro-RNAs (miRNAs): Diese winzigen RNA-Moleküle können entweder als Tumorsuppressoren oder als Onkogene wirken und die Krebsentwicklung beeinflussen.
- Long non-coding RNAs (lncRNAs): Diese längeren RNA-Moleküle beeinflussen die Genexpression und sind von zentraler Bedeutung für die epigenetische Regulierung.
Mittels öffentlicher Datenbanken, Blut von Lungenkrebspatienten, Krebszelllinien und bioinformatischen Analysen untersuchen wir ncRNAs mit der Fragestellung:
- Diagnostische Biomarker: Können zirkulierende ncRNAs als Frühindikatoren für Lungenkrebs dienen?
- Mechanismus: Wie beeinflussen diese ncRNAs das Fortschreiten von Krebs?
- Prädiktive und prognostische Marker: Können sie bei Behandlungsentscheidungen helfen?
Die Ergebnisse dieser Analysen versuchen wir in praktische klinische Anwendungen zu übersetzen, um Behandlungstrategien und damit das Überleben von Patientinnen und Patienten zu verbessern.
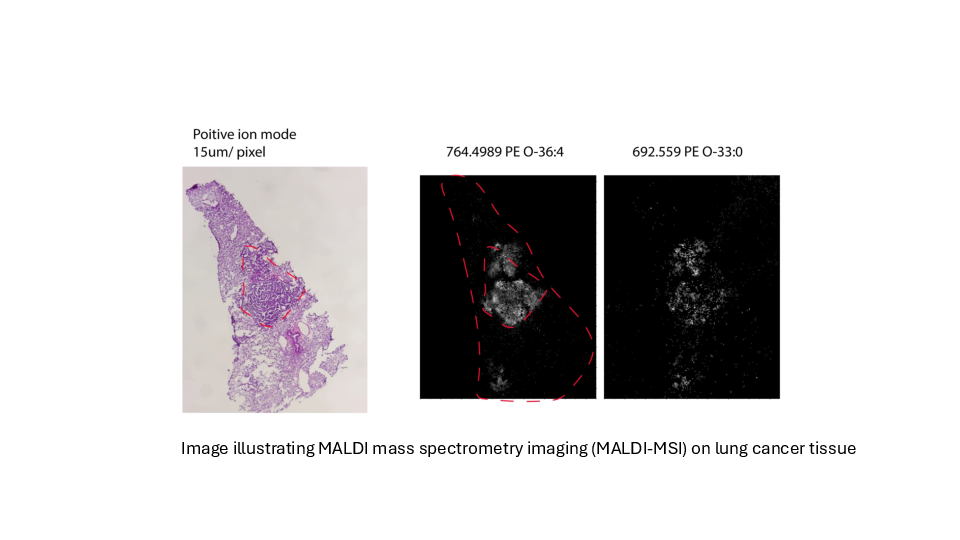
Bestimmung der Tumorlipidheterogenität bei Lungenkrebs
Gruppe Konstantinidou PD. Dr. Georgia Konstantinidou, PhD
Lungenkrebs ist weltweit die häufigste krebsbedingte Todesursache. Tumorassoziierte Mutationen von KRAS treten bei etwa 30 Prozent des nicht-kleinzelligen Lungenkrebses auf, der häufigsten Form von Lungenkrebs.
KRAS-Mutationen sind sowohl beim Menschen als auch in Mausmodellen mit aggressiven, metastasierenden und therapieresistenten Krebsarten assoziiert. Mutiertes KRAS treibt ein komplexes Netzwerk von Lipidstoffwechselumlagerungen an, um die Anpassung von Krebszellen an Hypoxie zu unterstützen und ihr Überleben zu sichern.
Wir planen, die transkriptomischen und lipidomischen Veränderungen zu bestimmen, die in Lungentumoren während der Krebsprogression und der Therapieresistenz auftreten, und ihre funktionelle Bedeutung zu untersuchen. Dabei berücksichtigen wir die Tumor-zu-Tumor-Heterogenität und bewahren zugleich die räumliche Organisation der Krebszellpopulationen innerhalb des Tumormikromilieus.
Zielgerichtete Untersuchungen des Zellstoffwechsels zur Verbesserung der Krebstherapie
Gruppe Marti PD Dr. Thomas Michael Marti
In diesem Projekt wird untersucht, wie der Nukleotid-/Laktat-Stoffwechsel und die DNA-Schadens-Reparatur-Maschinerie mit der Fähigkeit zur Tumorbildung, dem Ansprechen auf Chemotherapien und zur Metastasierung von Lungen- und Mesotheliom-Krebsstammzellen zusammenhängen. Darüber hinaus nutzen wir therapieinduzierte, zelluläre Anpassungen als neue Angriffspunkte für die Krebstherapie.
Onkogene Signalwege von Rezeptortyrosinkinasen im Zusammenspiel mit DNA-Schadensreaktion
Gruppe Medová PD Dr. Michaela Medová
Tyrosinkinase-Rezeptoren aktivieren eine Vielzahl unterschiedlicher zellulärer Signalwege. Physiologisch ist eine intakte Signalübertragung über den MET-Rezeptor für die Embryonalentwicklung und die Gewebehomöostase unverzichtbar. Gleichzeitig fördert eine MET-Dysregulation Merkmale, die eindeutig mit Tumorwachstum und -progression verbunden sind, wie z. B. unkontrollierte Proliferation, Angiogenese, lokale Invasion und systemische Verbreitung.
Immer mehr Daten deuten darauf hin, dass die MET-Signalübertragung Tumorzellen auch vor DNA-Schäden schützen kann, was ihre abnormale Aktivität mit der Resistenz gegen DNA-schädigende Wirkstoffe in Verbindung bringt, die routinemässig bei der Krebsbehandlung eingesetzt werden.
Wir haben eine bisher unbekannte Phosphorylierungsstelle auf MET identifiziert, die von DNA-Schadens-Masterkinasen erkannt werden kann und nicht nur an zellulären Reaktionen auf DNA-Schäden, sondern auch an Metastasierungsprozessen, der Migration von Krebszellen und dem verankerungsunabhängigen Wachstum beteiligt ist.
Ziel dieses Projekts ist es, die Natur, Funktion und Regulation dieser Phosphorylierungsstelle bei der onkogenen Signalübertragung des Rezeptors zu untersuchen.
Entschlüsselung von Therapieresistenzmechanismen für die Präzisionsmedizin bei Lungenkrebs und Mesotheliom
Gruppe Peng Prof. Ren-Wang Peng
Lungenkrebs und malignes Pleuramesotheliom (MPM) sind wichtige Thoraxtumoren, die sich durch eine hohe Morbidität und Mortalität sowie durch grosse Heterogenität und Therapieresistenz auszeichnen.
Es besteht ein ungedeckter Bedarf an einem besseren Verständnis der Resistenzmechanismen, an der Identifizierung neuartiger Angriffspunkte und Strategien zur Verhinderung oder Überwindung der Therapieresistenz sowie an der rationalen Entwicklung von Ansätzen der Präzisionsmedizin für ein personalisiertes Krankheitsmanagement, um die klinischen Ergebnisse für Patienten mit Thoraxtumoren zu verbessern.
Die Rolle des Minor-Spleissosoms bei Krebs
Gruppe Rubin Prof. Mark A. Rubin MD
Gene bestehen aus kodierenden Einheiten (Exons), die durch nicht kodierende Regionen, den Introns, voneinander getrennt sind. Bei der Herstellung von Proteinen werden Exons zusammengespleisst und Introns aus dem mRNA-Molekül entfernt. Für diesen Spleissvorgang hat die Evolution einen zellulären Apparat, das so genannte Speissosom, hervorgebracht. Alternatives Spleissen ermöglicht die Erzeugung verschiedener Proteinisoformen aus einem einzigen Gen. Unter normalen physiologischen Bedingungen ist der Spleissprozess streng reguliert.
Unsere neusten Resultate zeigen, dass Krebszellen ein spezialisiertes Spleissosom, das so genannte Minor-Spleissosom, nutzen, um krebsrelevante mRNAs zu vermehren. Krebs macht sich also die Minor-Intron-Spleissmaschinerie zunutze, um die Expression von Minor-Intron-enthaltenden Transkripten zu steigern. Von Minor-Intron-Genen kodierte Proteine scheinen speziell für das Überleben der Zelle (z. B. Regulierung des Zellzyklus oder DNA-Reparatur) wichtige Gene zu aktivieren.
Die Ausnutzung dieser Abhängigkeit der Krebszellen von Minor-Intron-enthaltenden Genen stellt eine neue therapeutische Möglichkeit der gezielten Krebsbekämpfung dar. Durch Hemmung des Minor-Spleissosoms können wir selektiv den Zelltod in Krebszellen auslösen, während gesunde Nachbarzellen verschont bleiben.